STUDENÁ FŮZE nebo ELEKTROLÝZA? - Plazmový rozklad vody a Těžké voda - D2O ,deuterium, tritium
Co je to STUDENÁ FŮZE? Existuje? Pořád o ní slyšíme, každou chvíli nekdo tvrdí že se mu ji podařilo uskutečnit, ale použitelné výsledky nikde. Pojďme se na toto téma trochu podívat a upřesnit si některé pojmy. Nejprve jak je studená fůze definována:
Wikipedie praví:
Jako STUDENÁ FŮZE bývá označován jeden specifický způsob provedení jaderné fůze ( Jaderná (nukleární) fůze je proces, při kterém dochází ke sloučení lehkých atomových jader a zároveň dochází k uvolnění energie (4H - 2He+energie). Proti slučování jader působí odpudivá elektrická interakce (obě jádra jsou kladně nabitá). Dostanou-li se však lehká jádra dostatečně blízko k sobě, převládne nad elektrickou silou přitažlivá jaderná síla a obě jádra se sloučí. Rozdíl mezi klidovými hmotnostmi jader před a po sloučení se uvolní ve formě energie. Jedním ze způsobů, jak fúze dosáhnout, je pomocí vysoké teploty a tlaku, které způsobí, že do sebe jádra mohou narazit s dostatečnou energií k překonání coulombovské bariéry. V tom případě mluvíme termonukleární fůzi ), který v roce 1989 popsali Martin Fleischmann a Stanley Pons.
Někdy se pojmem studená fúze označuje jakýkoliv způsob dosažení jaderné fúze bez použití vysokých teplot.
V roce 1989 Fleischmann a Pons publikovali článek, kde deklarovali že se jim podařilo provést fúzi za běžných teplot pomocí elaktrolýzi těžké vody. Tato zpráva vyvolala obrovský mediální rozruch a mnoho laboratoří se snažilo jejich pokusy zopakovat, některé z nich dokonce pozorování jevu potvrdily. Pozdější přesnější experimenty však Fleischmannovy a Ponsovy výsledky vyvrátily.
Od té doby se objevilo několik dalších prohlášení o pozorování studené fúze či dokonce o připravenosti jejího využití k výrobě energie (např. reaktor E-Cat), ale pozorování jevu byla buď vyvrácena, nebo nebyly poskytnuty údaje potřebné k reprodukovatelnosti a uváděné parametry pokusu intenzivně naznačují, že jde o podvod.
Většina oznámených pokusů je ovšem klasická ELEKTROLÝZA , uzpůsobená tak, aby se při ní uvolňovala silná EXOTERMNÍ REAKCE, kterou pak autoři rádoby využívají jako energetický (tepelný) zdroj. Jedná se tedy o CHEMICKÉ SLUČOVÁNÍ PRVKŮ a né o JADERNÉ SLUČOVÁNÍ.
Wikipedie o elektrolýze praví:
ELEKTROLÝZA je fyzikálně-chemický jev, způsobený průchodem elektrického proudu kapalinou, při kterém dochází k chemickým změnám na elektrodách.
Elektricky vodivá kapalina obsahuje směs kationtů a aniontů vzniklých v kapalině disociací. Průchodem elektrického proudu dochází k pohybu kladných iontů k záporné elektrodě a záporných iontů ke kladné elektrodě. Na elektrodách pak může docházet k chemickým reakcím - mezi ionty a elektrodou, mezi ionty samotnými nebo mezi ionty a kapalinou (díky vyšší koncentraci iontů u elektrody).
Příklady elektrolýzi:
Elektrolýza roztoku kuchyňské soli
Elektrolytem může být vodný roztok chloridu sodného NaCl (kuchyňská sůl), jenž je disociován na kladné ionty sodíku Na+ a záporné ionty chloru Cl−. Elektrody mohou být např. uhlíkové. Elektrické napětí mezi elektrodami usměrní pohyb Na+ k záporné elektrodě, ze které si iont H+ vezme elektron a změní se na elektricky neutrální částici - atom vodíku H, který se sloučí s jiným atomem vodíku za vzniku molekuly H2. Záporné ionty Cl− jsou přitahovány ke kladné elektrodě, které odevzdají svůj přebytečný elektron, a po dvou se sloučí do elektricky neutrální molekuly chloru Cl2. Na záporné elektrodě se z roztoku nevylučuje pevný sodík (to by se stalo, kdybychom místo vodného roztoku soli použili její taveninu - tímto procesem také lze s úspěchem kovový sodík vyrobit), ale probíhá zde redukce vodíku. Sodíkové kationty zůstávají v roztoku spolu s hydroxidovými anionty - jedná se o výrobu hydroxidu sodného.
Elektrolýza vody
Při elektrolýze vody se jako elektrolyt používá roztok kyseliny sýrové H2SO4 a ve vodě elektrody z platiny, která s kyselinou sírovou nereaguje. Disociací molekul kyseliny sírové vznikají v roztoku kladné ionty vodíku H+ a záporné ionty SO42−. Kationty vodíku se pohybují k záporné elektrodě, od které přijímají elektron a slučují se do molekuly vodíku H2. Anionty SO42− se pohybují ke kladné elektrodě, které odevzdají své přebytečné elektrony a elektricky neutrální molekula SO4 okamžitě reaguje s vodou - vzniká nová molekula H2SO4. Při této reakci se uvolňují molekuly kyslíku O2. U záporné elektrody se tedy vylučuje z roztoku vodík, u kladné elektrody se vylučuje kyslík. Přitom v elektrolytu zůstává stejný počet molekul kyseliny sírové H2SO4, zatímco ubývá molekul vody H2O, koncentrace roztoku se zvyšuje. K elektrolýze vody se používá Hoffmanův přístroj. Energetická účinnost elektrolýzy vody (získaná chemická energie/dodaná elektrická energie) dosahuje v praxi 60-70%.
Galvanické poměďování
Elektrolytem při galvanickém poměďování může být roztok síranu měďňatého CuSO4 ve vodě, kladná elektroda musí být z mědi, zápornou elektrodu tvoří vodivý předmět, který má být pokovován. CuSO4 se ve vodě disociuje na kationty mědi Cu2+ a anionty SO42−. Ionty Cu2+ jsou přitahovány k záporné elektrodě, na které postupně vytváří měděný povlak. Ionty SO42− jsou přitahovány ke kladné měděné elektrodě, z které vytrhují kationty mědi Cu2+. Koncentrace roztoku zůstává stejná, měděná elektroda se časem rozpouští.
Využití elektrolýzy
- Výroba chlóru
- Rozklad různých chemických látek (elektrolýza vody)
- Elektrometalurgie - výroba čistých kovů (hliník)
- Elektrolytické čištění kovů - rafinace (měď, zinek, nikl)
- Galvanické pokovování (chromování, niklování, zlacení) - pokrývání předmětů vrstvou kovu
- Galvanoplastika - kovové obtisky předmětů, např. pro výrobu odlévacích forem
- Galvanické leptání - kovová elektroda se v některých místech pokryje nevodivou vrstvou, nepokrytá část se průchodem proudu elektrolytem vyleptá
- Polarografie - určování chemického složení látky pomocí změn elektrického proudu procházejícího roztokem zkoumané látky
- Akumulátory - nabíjení chemického zdroje elektrického napětí průchodem elektrického proudu
Schematický průběh elektrolýzy
Wikipedie o exotermní reakci praví:
EXOTERMNÍ (exotermická) REAKCE je reakce, při níž se uvolňuje energie (uvolňuje se teplo), protože reaktanty mají větší energii než produkty. Například hoření je exotermická reakce, protože se uvolňuje teplo a světlo. Další je např. exploze. Opakem je reakce endotermická, kde musíme teplo neustále dodávat, aby reakce mohla probíhat. Př: 2H2 (g) + O2 (g) → 2H2O (ag) Qr = - 484 kJ mol-1 – reagující látky předávají teplo okolí, reakční teplo tedy má zápornou hodnotu
A teď k samotným pokusům.
STUDENÁ FŮZE - Plazmový rozklad vody a Těžké vody, D2O , oxidu deuteria
Při pokusech se STUDENOU FÚZÍ byla použitaje elektrolýza DEUTERIA elektrodami z palladia(katoda) a titanu(anoda). Při fůzi probíhající například na Slunci, nebo v jakékoliv hvězdě se při velmi vysoké teplotě slučují atomy vodíku v hélium, protože při takto vysoké teplotě ztrácejí své elektronové obaly(mění se v plazmu), takže jim při slučování nic nebrání. Při "STUDENÉ FÚZI" by se měli slučovat atomy vodíku v hélium při celkem nízké teplotě díky elektřině, která jim má pomoci překonat vzájemné odpuzování.
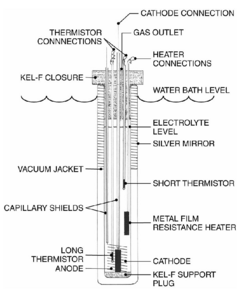


PLAZMOVÁ ROZKLAD VODY: U klasické elektrolýzi vody se voda rozkládá elektřinou na vodík a kyslík. K tomu je potřeba .určité množství energie. Když potom ten vodík s kyslíkem spálím, dostanu stejné množství energie, které jsem do rozkladu vložil, spíše méně. U PLAZMOVÉ ELEKTROLÝZI je údajně množství uvolněné energie, tedy tepla, několikanásobně vyšší než množství přivedené elektrické energie. To dokazují experimenty které provádí Jean Louis Naudin a mnoho jiných lidí. Naměřená účinnost je přibližně 200% i více. Poté by ovšem nemohl platit zákon zachování energie. Ale kde se tato přebytečná energie bere? Studenou fůzi vědci odmítli z důvodu chybějícího ionizujícího záření, tedy ά, β, γ, n. Radiace ale vzniká jenže je odstíněna vodou a není ji mnoho. Probíhá i transmutace prvků, což jaderné reakce dokazuje. Ale je zvláštní, že se dá použít i obyčejná voda, která obsahuje pouze 0,001% TĚŽKÉ VODY (D2O), tedy vody obsahující izotop vodíku schopný jaderné fúze.
Co praví Wikipedie o oxidu deuteria, oxidu tritia a těžké vodě D2O
Jako DEUTERIUM se označuje atom s jádrem 2H, který obsahuje v jádře jeden proton a jeden neutron a od běžného vodíku se liší především atomovou hmotností, která činí 2,01363 amu. Někdy mu bývá přiřazována i chemická značka D, přestože se nejedná o jiný prvek. Jádro deuteria se označuje jako deuteron. Deuterium je stabilní izotop, který nepodléhá radioaktivní přeměně. V přírodě se běžně vyskytuje namísto lehkého vodíku. V průměru připadá na jeden atom deuteria 6 000 atomů normálního vodíku. Ve spojení s kyslíkem tvoří deuterium tzv. TĚŽKOU VODU - D2O. Tato sloučenina má významné využití v jaderném průmyslu. Je velmi účinným moderátorem, tedy látkou zpomalující rychlost neutronů. Této vlastnosti se již od druhé světové války využívá v určitém typu jaderných reaktorů k přípravě plutonia z uranu. Německá armáda se za druhé světové války intenzivně snažila vyvinout jadernou bombuna bázi plutonia. V norském Rjukanu existoval průmyslový komplex společnosti Norsk Hydro, vyrábějící těžkou vodu. Spojenci tento komplex zničili operací zvláštních jednotek (bombardování po jeho opravě způsobilo těžké ztráty na životech místních obyvatel, ale továrnu poškodilo jen mírně), přesto se však nacistům podařilo vyrobit dostatečné množství těžké vody pro další experimenty s jadernou zbraní. Dnes je deuterium využíváno také jako účinný stopovač biochemických reakcí. Pokud je na počátku výzkumu distribuce určité sloučeniny v organizmu použita látka, která má atomy vodíku nahrazeny deuteriem, lze vysledovat její cestu biochemickou přeměnou analýzou všech možných vzniklých produktů. Deuterium vzniká v jádrech hnědých trpaslíků.
TRITIUM je radioaktivní izotop vodíku (3H). Jádro tritia obsahuje jeden proton a dva neutrony, zatímco normální vodíkové jádro sestává pouze z jednoho protonu. Jeho relativní atomová hmotnost je 3,016049. Za standardního tlaku a teploty je to plyn (T2 nebo 3H2). Tritium je beta zářič (β-), při svém rozpadu produkuje elektron (e-) a antineutrino a vzniká 3He. Poločas rozpadu je 12,32 let. Někdy mu bývá přiřazována i chemická značka T, přestože se nejedná o jiný prvek. Ve sloučenině s kyslíkem tvoří TRITIOVOU VODU - T2O. Nejčastěji se můžeme s použitím tritia setkat v tzv. tritiové barvě. Tato barva (uzavřená v průhledných mikrokapslích) vlivem rozpadu tritia svítí (ciferníky hodinek, mířidla zbraní). Tritium se vlivem ionizujícího záření z vesmíru vyskytuje ve vrchních vrstvách atmosféry a ve stopovém množství i v běžné vodě.
TĚŽKÁ VODA, D2O, oxid deuteria je voda, jejíž molekuly obsahují místo obou atomů vodíku jeho izotop deuterium - tedy vodík s jádrem tvořeným 1 protonem a 1 neutronem. Proti běžné vodě (H2O) má D2O mírně odlišné fyzikální vlastnosti. Ve větších množstvích je zdraví škodlivá, neboť narušuje fyzikální rovnováhu v těle. Není radioaktivní. Existuje i polotěžká voda, HDO, tedy voda, kde je jeden atom běžného vodíku (protia) a jeden atom deuteria. Ta se v malých koncentracích vyskytuje zcela běžně v přírodě. Ve velmi malém množství se vyskytuje i radioaktivní tritiová voda (T2O), která obsahuje dva atomy tritia. Také existují sloučeniny HTO a DTO. Těžká voda je méně reaktivní než voda běžná a má horší rozpustné vlastnosti. Proto je pro většinu organismů mírně jedovatá. Experimenty na myších ukázaly, že potlačuje buněčné dělení. To se projevuje na rychle se obnovujících tkáních (např. žaludečnáí stěně) při jejím opakovaném působení. Tento jev byl u myší pozorován, jestliže zhruba 50 % jejich tělních tekutin bylo nahrazeno těžkou vodou. Z toho vyplývá, že i agresivnírakovinná onemocnění by jí měla být zpomalována. Vedlejší účinky takové terapie by byly však jen těžko vyváženy.
-
Vlastnost Těžká voda (D2O) Normální voda (H2O) Teplota tání 3,82 °C 0 °C Teplota varu (při normálním tlaku) 101,42 °C 100 °C Maximální hustota 1,1072 g/cm3 0,9997 g/cm3 Maximální hustota je při 11,2 °C 3,98 °C Hodnota pKw při 25°C 14,869 14,000 pH (při 25 ° C) 7,41 7,00
Těžká voda má o 10,6 % větší hustotu než obyčejná voda. Těžká voda se v přírodě běžně vyskytuje, avšak je poměrně značně zředěna. Při izolaci se využívá faktu, že vazba D-O je silnější, než-li H-O. To se projevuje tím, že při elektrolýze běžné směsi těžké a lehké vody dochází nejprve k rozpadu H2O. Vzniká tak stále koncentrovanější roztok D2O a DHO (polotěžké vody). Nakonec se odebere zbylé malé množství elektrolytu a ten se obdobnou metodou ještě přečišťuje. Těžká voda se využívá jako moderátor v jaderných reaktorech, kde při stejně silném moderačním účinku pohltí méně neutronů než obyčejná voda. Proto je možné upustit od, u lehkovodních reaktorů nutného, obohacování uranu. V NMR spektroskopii se těžká voda využívá pro stabilizaci magnetického pole a jako rozpouštědlo pro měření protonových NMR spekter.Dále těžká voda slouží k syntéze ostatních sloučenin obsahujících deuterium.
TRITIOVÁ VODA, oxid tritia, tritiový analog vody, trojnásob těžká voda, supertěžká voda, chemicky T2O, 3H2O, je voda, jejíž molekuly obsahují místo obou atomů vodíku jeho izotop tritium – tedy vodík s jádrem tvořeným 1 protonem a 2 neutrony. Tritiová voda je radioaktivní.
A teď naše pokusy ...

